[GAM] ① 서밋, 사상 최고가...'이보네시맙' 병용요법도 표준치료법 제쳐
 코투선
0
6
2025.04.27 08:04
코투선
0
6
2025.04.27 08:04
이 기사는 4월 25일 오후 4시58분 '해외 주식 투자의 도우미' GAM(Global Asset Management)에 출고된 프리미엄 기사입니다. GAM에서 회원 가입을 하면 9000여 해외 종목의 프리미엄 기사를 보실 수 있습니다.
[서울=뉴스핌] 김현영 기자 = 바이오 제약사 서밋 테라퓨틱스(종목코드: SMMT)의 주가가 24일(현지 시각) 뉴욕증시에서 주당 36.91달러로 사상 최고가를 경신했다. 서밋의 폐암 치료 후보 물질 '이보네시맙(ivonescimab)'이 중국 파트너사 아케소(9926.HK)가 편평 비소세포폐암(NSCLC) 환자를 대상으로 진행한 임상 3상 시험에서 또다시 기존 표준치료법을 앞지르며 통계적으로 유의미한 무진행 생존기간(PFS) 개선을 보인 결과다.
 |
| 서밋 테라퓨틱스와 아케소의 로고 [사진=서밋 홈페이지] |
◆ 혁신적인 이중 작용 메커니즘으로 주목받는 이보네시맙
현재 서밋의 주요 파이프라인 후보물질인 이보네시맙은 비소세포폐암 치료를 위해 개발 중이며, 세계적인 제약사 머크(MRK)의 블록버스터 면역 치료제 '키트루다(Keytruda, 성분명: 펨브로리주맙)'와 비교했을 때 암 진행 또는 사망 위험을 크게 감소시키는 것으로 나타났다.
이보네시맙은 PD-1(체내 면역계의 T세포가 암세포를 공격하지 못하도록 막는 단백질) 차단을 통한 면역 치료 효과와 동시에 혈관내피세포성장인자(VEGF) 차단으로 암세포에 혈액 공급을 중단하는 계열 내 최초의 이중특이항체다.
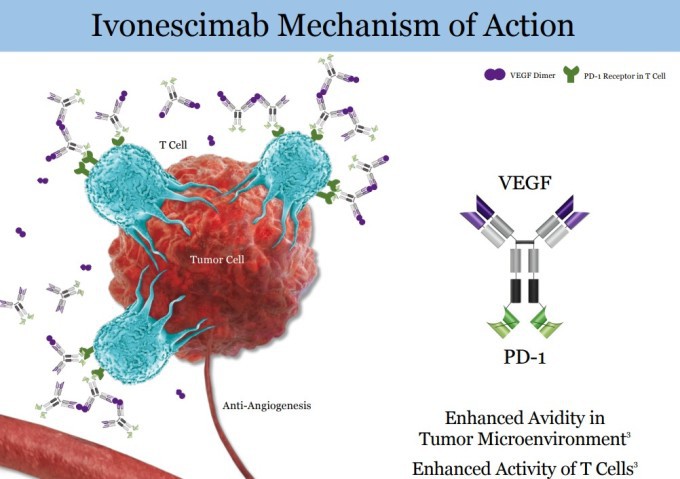 |
| 이보네시맙의 작용 원리 [사진=서밋 테라퓨틱스] |
이보네시맙은 키트루다(2028년 특허 만료)와 다른 메커니즘으로 작용한다. 면역 억제 단백질 PD-1만 차단하는 키트루다와 달리 이보네시맙은 PD-1과 종양 성장에 관여하는 또 다른 표적인 VEGF를 동시에 억제하는 혁신적인 접근법이다.
PD-1은 암세포가 면역 시스템으로부터 자신을 위장하고 보호하는 데 사용하는 단백질로, 이 단백질을 타겟으로 하면 체내 면역 세포가 비로소 암세포를 알아보고 공격할 수 있게 되는 셈이다. 이보네시맙이 새로운 혈관 형성을 방지하기 위해 VEGF 단백질을 억제하면 암세포로의 혈액 공급이 차단된다.
◆ 연이은 임상 성공으로 입증된 효능과 안전성
지난 23일 공개된 'HARMONi-6(또는 NCT05840016)' 임상 3상 연구에서 이보네시맙의 PD-1 억제제 대비 우수성이 다시 한번 입증됐다. 이 연구는 PD-L1 발현 수준에 관계없이 국소 진행성 또는 전이성 편평 비소세포폐암(NSCLC) 환자를 대상으로 진행됐다.
 |
| 테빔브라(성분명: 티슬렐리주맙) 로고 [사진=베이진 홈페이지] |
이보네시맙을 백금 기반 화학요법과 함께 투여한 경우와 현재 표준치료법인 중국 바이오 제약사 베이진(百濟神州, 종목코드: 6160.HK/BGNE.나스닥/688235.SH)의 PD-1 억제제 티슬렐리주맙(tislelizumab, 제품명: 테빔브라)을 백금 기반 화학요법과 병용하는 경우를 비교 평가했다.
중국 내 66개 기관에서 실시된 이 임상시험에는 532명의 환자가 등록했으며, 이 중 약 63%가 편평 비소세포폐암 환자였다. 중간 분석에서 이보네시맙+화학요법 병용요법은 티슬렐리주맙+화학요법 병용요법에 비해 무진행 생존기간을 통계적으로, 임상적으로 유의미하게 개선시킨 것으로 나타났다. 이러한 혜택은 PD-L1 양성과 음성 종양을 가진 환자 모두에서 확인됐으며, 새로운 안전성 문제는 발견되지 않았다.
◆ 업계 최초의 PD-(L)1 억제제 대비 우수성 입증
업계에서는 지금까지 비소세포폐암 임상 3상 시험에서 PD-(L)1 억제제+화학요법 병용요법과 직접 비교했을 때 통계적으로 유의미한 개선 효과를 보인 치료제는 이보네시맙이 처음이라는 데 주목하고 있다.
지난해 PD-1 억제제 펨브롤리주맙과 비교한 단독요법에 이어 올해 또 다른 PD-1 억제제 티슬레리주맙과 화학요법 병용요법에서도 이점을 보인 것이다.
지난해 공개된 'HARMONi-2' 임상 3상 연구에서는 중국에서 PD-L1 발현이 양성인 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자 398명을 대상으로 이보네시맙 단독요법과 펨브롤리주맙(키트루다) 단독요법을 비교 평가했다.
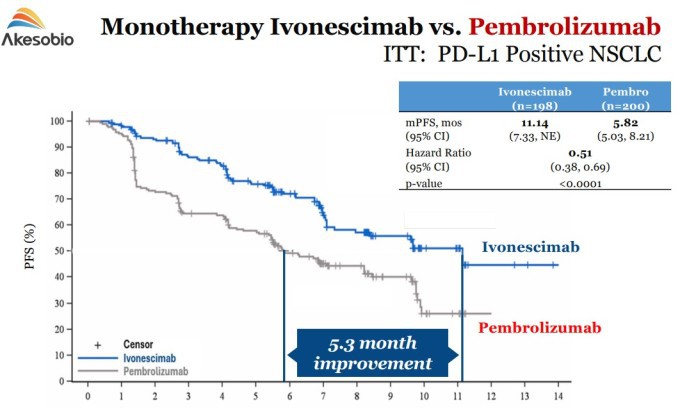 |
| 이보네시맙 vs 펨브롤리주맙(키트루다) 단독요법 비교 [자료=서밋 테라퓨틱스] |
그 결과, 이보네시맙을 투여한 환자가 평균 11.14개월 동안 종양이 억제되어, 키트루다를 투여한 환자(평균 5.82개월 종양 억제)보다 무진행 생존기간이 5.3개월 더 길었다. 이는 암 진행 또는 사망 위험을 통계적으로 유의미하게 49% 감소시킨 것과 같다고 분석됐다.
◆ FDA 승인을 위한 다지역 임상 진행
2024년 5월 중국에서 아케소는 이보네시맙(제품명: 이다팡)의 승인을 이끌어냈지만, 서밋이 미국을 포함한 다국가 임상을 진행하지 않으면 미국 식품의약국(FDA)으로부터 승인을 받을 가능성은 낮다. 이에 따라 서밋은 다지역 임상 3상 'HARMONi-3' 시험(NCT05899608)의 환자 등록을 진행 중이며, 'HARMONi-7' 시험(NCT06767514)도 준비하고 있다.
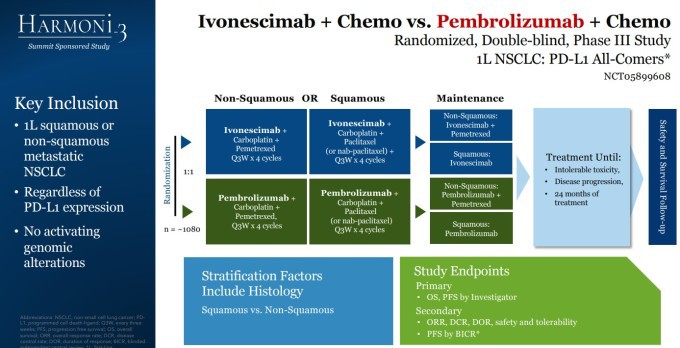 |
| 'HARMONi-3' 임상 계획 [자료=서밋 테라퓨틱스] |
HARMONi-3은 서밋이 후원하는 다지역 임상시험으로, 전이성 편평 및 비편평 비소세포폐암 1차 치료 환자를 대상으로 이보네시맙+화학요법 병용요법과 펨브롤리주맙+화학요법 병용요법을 평가한다. 이 임상시험의 데이터는 미국을 포함해 서밋이 라이선스를 보유한 지역에서 허가 신청을 뒷받침할 수 있다.
지난해 HARMONi-2 임상시험의 단독요법 결과 발표 후, 일각에선 현재 대부분의 비소세포폐암 환자에게 표준 치료법으로 사용되는 키트루다와 화학요법 병용요법에 대해 이보네시맙을 시험하지 않았다는 것을 한계점으로 지적했다.
이 가운데 테빔브라에 이어 키트루다 화학요법 병용 임상시험에서도 임상적, 통계적으로 유의미한 결과가 나오면 규제당국의 승인을 받는 데 큰 도움이 될 전망이다.
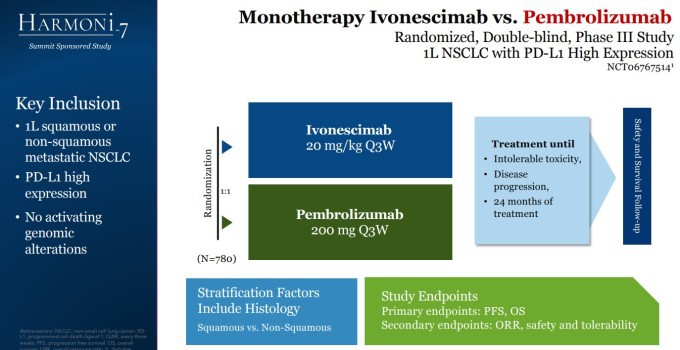 |
| 'HARMONi-7' 임상 계획 [자료=서밋 테라퓨틱스] |
HARMONi-7은 PD-L1 발현이 양성인 국소 진행성 또는 전이성 비소세포폐암 환자에서 이보네시맙 단독요법과 펨브롤리주맙 단독요법을 평가하는 다지역 3상 임상시험으로, 현재 전 세계적으로 환자를 등록하고 있다.
▶②편에서 계속됨




